El laboratorio Pfizer presentó este miércoles 2 de diciembre la documentación a la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) para que autorice el uso de su vacuna contra el coronavirus en Argentina.
Así lo informó el ministro de Salud, Ginés González García, en diálogo con el programa "Crónica de una tarde anunciada", que conduce Nelson Castro por radio Rivadavia.
"Hoy se presentó en el ANMAT Pfizer para autorizar la vacuna en la Argentina", dijo el funcionario y explicó que el procedimiento "exige toda la documentación de los estudios que se han hecho".
La vacunación contra el Covid en el Reino Unido arranca en una semana
Según indicó, ante la urgencia que impone la pandemia "lo que se está haciendo es una cuestión más rápida de autorización". "Claramente si lo consiguieron en Inglaterra es porque tienen toda esta fase", apuntó.
Si bien el ministro no dio fecha para que se complete el proceso de autorización, consideró que a su juicio Pfizer "tiene holgadamente todo lo que tiene que tener" para conseguir el aval de la ANMAT.
"Si aprobó el Reino Unido yo estoy convencido en que tiene holgadamente todo lo que tiene que tener, pero no puedo anticiparlo porque no depende de mi, es una decisión técnica", explicó.
Gran Bretaña se convirtió este miércoles en el primer país del mundo en aprobar la vacuna Pfizer/BioNTech COVID-19 para su uso, que se implementará desde la próxima semana.
Coronavirus: Pfizer pide autorización de emergencia para su vacuna en Europa
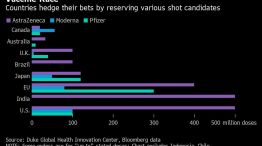
La conservación en ultrafrío de la vacuna de Pfizer, un desafío para la distribución
La vacuna contra el coronavirus desarrollada por Pfizer y BioNTech requiere una conservación a -70 °C (con un margen de 10°C más o menos) y si bien las empresas anunciaron que desarrollaron transportadores especiales que sólo necesitan hielo seco y luego se pueden utilizar para almacenar por 30 días, especialistas advierten que igual la logística será complicada en algunos países.
En su comunicado difundido este miércoles con el anuncio de la aprobación para su uso de emergencia en el Reino Unido, las compañías detallaron que "para garantizar la calidad del producto, las empresas han desarrollado transportadores de temperatura controlada especialmente diseñados para la vacuna candidata BNT162b2, que pueden mantener las condiciones de almacenamiento recomendadas (-70 ° C ± 10 ° C) durante períodos prolongados de tiempo sin ningún equipo adicional que no sea hielo seco".
La idea de las empresas es que las dosis se envíen cuando cada país comience la vacunación para que ninguno deba "almacenar la vacuna por más de 30 días".
EuDr