Medtronic, el gigante estadounidense de los productos médicos, domina desde hace tiempo el mercado de las bombas de insulina para el tratamiento de la diabetes tipo 1, la más grave. Se suele desarrollar en niños y jóvenes adultos y representa entre el 5 y el 10 % del total de los casos de la enfermdad.
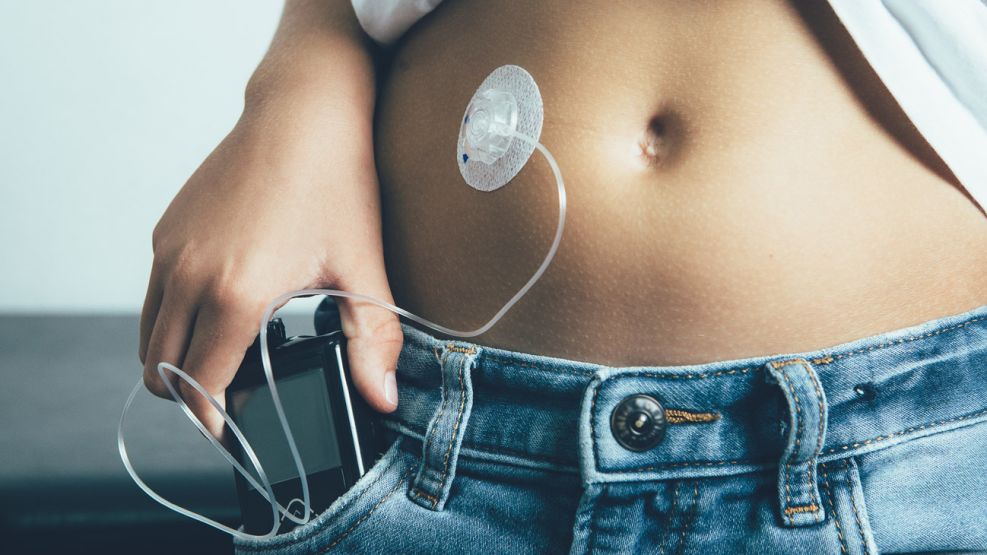
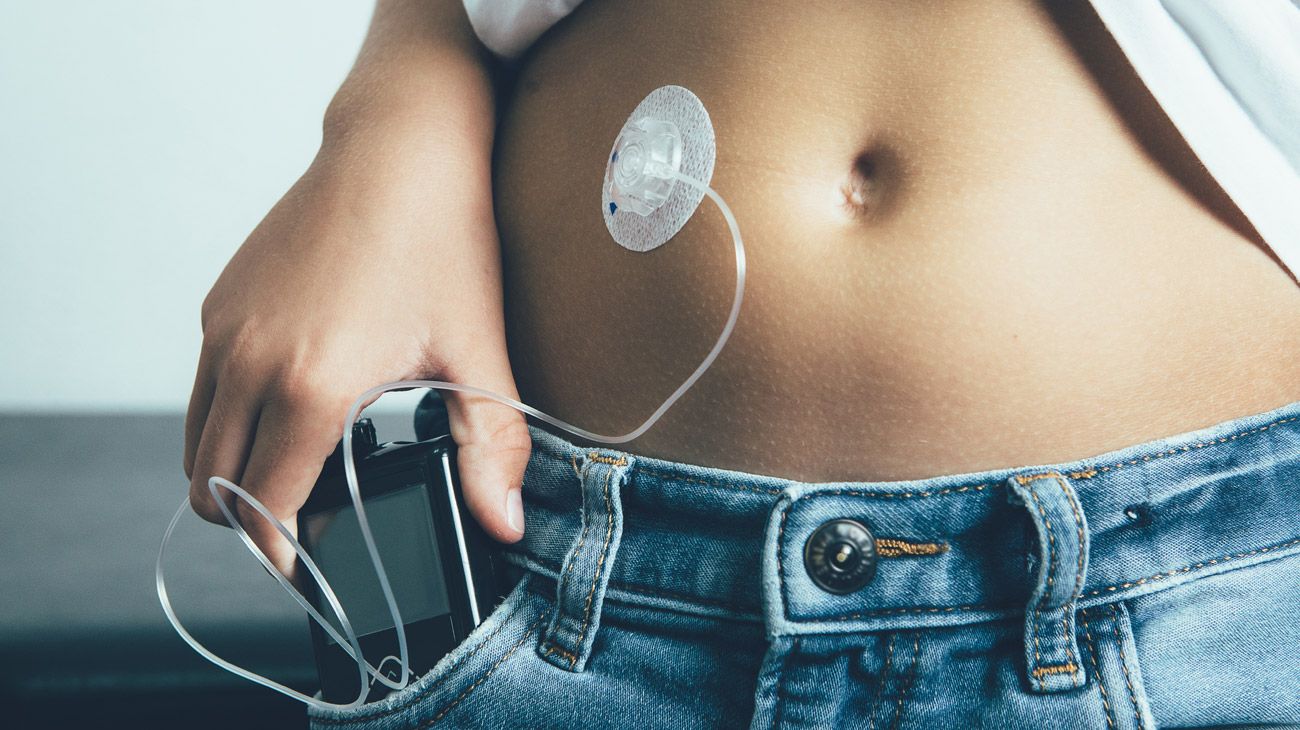
La mayor apuesta de Medtronic para crecer ha sido su unidad para combatir y aliviar la diabetes, ubicada en Northridge, California. Ese departamento fabrica monitores de glucosa, sensores y bombas de insulina. La inyección de dosis controladas de insulina elimina la necesidad de estar pinchándose constantemente en la yema de los dedos para medir la cantidad de glucosa y las molestas inyecciones diarias.
La inyección de dosis controladas de insulina elimina la necesidad de estar pinchándose constantemente en la yema de los dedos para medir la cantidad de glucosa y las molestas inyecciones diarias.
El mercado mundial de diabetes, tanto de fabricantes de medicinas como de dispositivos, es enorme. Gobiernos de todo el mundo gastaron US$ 1,3 billones en tratamientos para la diabetes en 2015, según la Asociación Estadounidenses de Diabetes (American Diabetes Association). Los gastos se están incrementando. Una bomba de insulina puede llegar a costar US$ 6.000 anuales y las cargas de insulina entre US$ 3.000 y US$ 6.000.
Más de 250 periodistas y analistas de datos de 58 medios de 36 países han trabajado durante un año para publicar la investigación ‘The Implant Files’, coordinada por el Consorcio Internacional de Periodistas de Investigación (ICIJ). Medtronic es uno de los focos de este trabajo. Entrevistamos o revisamos los comentarios de más de 50 empleados de Medtronic, hablamos con decenas de funcionarios, pacientes, médicos y expertos. Se examinaron decenas de miles de páginas de documentos judiciales, registros de empresas, informes normativos, auditorías públicas, archivos de los grupos de presión, transcripciones de llamadas de analistas, artículos científicos y otros tipos de documentación.
En los últimos años, los competidores han comenzado a comercializar innovadores dispositivos para combatir la diabetes, erosionando la ventaja tecnológica de Medtronic. La presión ha crecido dentro del departamento de Northridge para vender más.
Según una demanda interpuesta por Adam Witkin, un ex jefe comercial de Medtronic en Oregón, Estados Unidos, la compañía se planteó ampliar su base de clientes con la diabetes tipo 2, que se asocia a la obesidad y a la vejez. Witkin indicó que la empresa recompensaba a los médicos que promocionaban el uso de las bombas de insulina de Medtronic con charlas, equipamiento gratis, financiamiento de investigaciones, viajes y lujosas cenas.
Witkin indicó que la empresa recompensaba a los médicos que promocionaban el uso de las bombas de insulina de Medtronic con charlas, equipamiento gratis, financiamiento de investigaciones, viajes y lujosas cenas.
Una memoria de Medtronic, adjuntada como prueba a la causa judicial, animaba a los representantes a desarrollar relaciones con los empleados de la oficina del doctor y describía cuán fácil era acceder a información confidencial de los pacientes en una clínica de un endocrinólogo en La Vegas. “En una ocasión estuve revisando todos los documentos relativos a los pacientes y pude subrayar los potenciales clientes de bombas de insulina. Hay que hacerlo de nuevo”, señalaba el autor del escrito.
Witkin afirmó que fue despedido por no cumplir con los objetivos de ventas de las bombas de insulina. Medtronic contravino sus acusaciones y aseguró en sede judicial que la división de diabetes salvaguardaba los estándares éticos más altos.
Otro trabajador del departamento de diabetes, David Zuzick, alertó en cuatro ocasiones a los supervisores que el nuevo dispositivo de control de la glucosa, Sentrion, aún no estaba listo para su utilización en pacientes. Ocurrió entre 2009 y 2013. El aparato había sido comercializado en Europa sin que se hubieran llevado a cabo los adecuados exámenes de seguridad, según una demanda autoinculpatoria que Zuzick presentó en la corte federal de California.
Zuzick, exdirector de planificación de producto, también señaló que los jefes de Medtronic le dijeron que no tuviera en cuenta los datos clínicos que “no defendieran la seguridad y el buen funcionamiento de Sentrino”.
Medtronic negó todas esas acusaciones de Zuzick ante los tribunales antes de alcanzar un pacto extrajudicial con él en 2017. En declaraciones al ICIJ, la empresa rehusó en todo momento que hubiera suprimido datos clínicos sobre producto alguno.
Durante el pleito, sus inquietudes sobre la calidad y los problemas de desarrollo del producto fueron ratificadas por la FDA, en septiembre de 2013 cuando esta autoridad mandó una carta de aviso a Medtronic. Citó errores similares a los denunciados por Zuzick durante casi dos años.
Hechos fehacientes
El director ejecutivo de Medtronic, Omar Ishrak, declinó hablar con los periodistas. En una declaración escrita, el portavoz de la multinacional, Rob Clark, indicó que la prioridad de Medtronic es la seguridad de los pacientes. Añadió que la empresa se debe a los “más altos estándares éticos en su negocio”.
Clark negó que se pagara a los médicos para usar o promocionar los productos de Medtronic de forma ilegal. La compañía no respondió a las cuestiones específicas sobre su mala praxis narrada a lo largo de este reportaje, pero subrayó que muchas de las acusaciones estaban basadas en “reclamaciones infundadas de los litigantes y críticos con la industria”.
“Las denuncias no son hechos fehacientes y no deberían ser interpretados para sugerir que Medtronic vulneró nuestras obligaciones legales, éticas y regulatorias”, afirmó Clark. Agregó que en los pocos casos en que los empleados o firmas afiliadas violaron las normas, ellos fueron castigados. “Nuestra reputación es el resultado del compromiso con la seguridad del paciente, la transparencia, la rendición de cuentas y una praxis empresarial ética”, explicó el portavoz.
Las ventas de los productos de Medtronic para combatir la diabetes incrementaron sus ventas en la medida en que países como Alemania, Australia o Chile autorizaban subvenciones o seguros médicos para adquirir las bombas de insulina. En Estados Unidos, Medtronic alcanzó acuerdos para vender sus bombas con la aseguradora UnitedHealthcare y el Departamento de los Veteranos de Guerra.
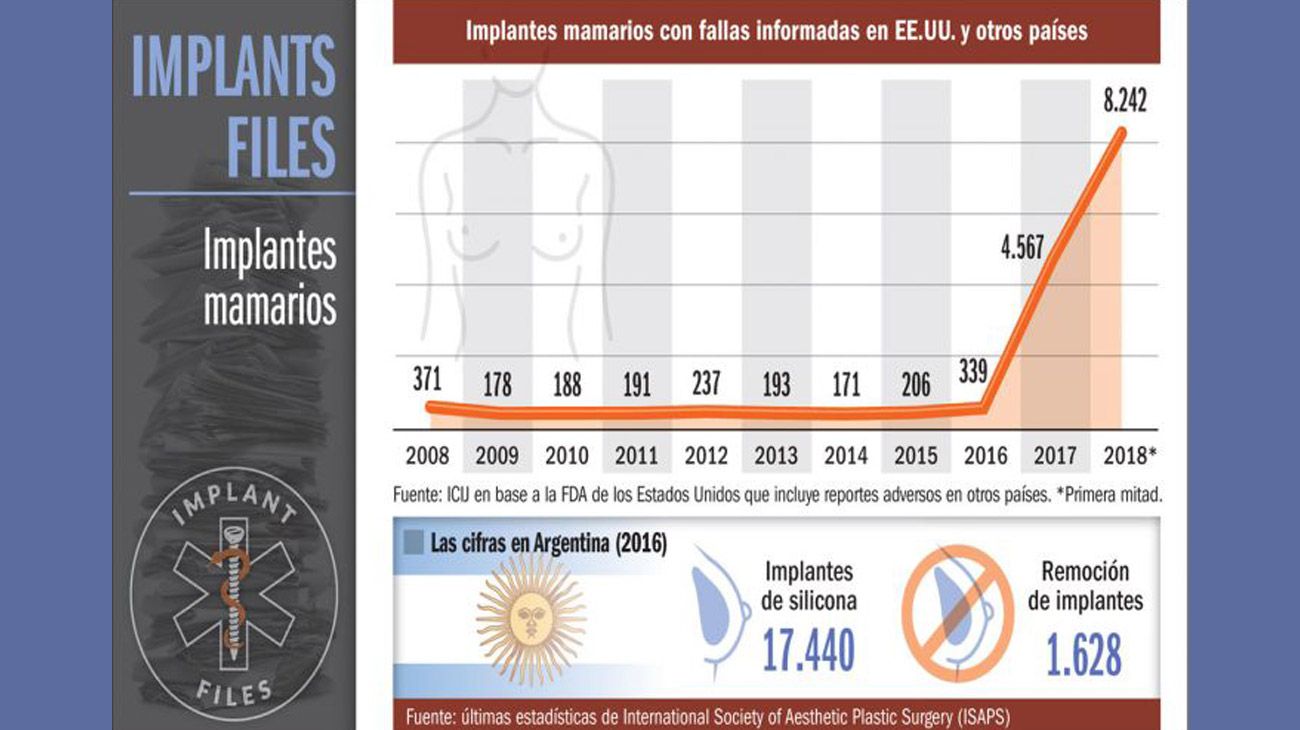
Durante el decenio 2008-2017, las bombas de insulina de Medtronic provocaron 20 retiradas del mercado y se interpusieron cerca de 100 causas judiciales por su mal funcionamiento.En una carta firmada en 2013, la FDA amonestó a la firma por no investigar o responder a tiempo a las reclamaciones de los consumidores o incluso a las muertes de pacientes. En uno de los casos, según la FDA, el aviso tardío sobre el posible mal funcionamiento de una bomba podría haber provocado una sobredosis de insulina, lo que a un paciente le originó un coma diabético.
En uno de los casos, según la FDA, el aviso tardío sobre el posible mal funcionamiento de una bomba podría haber provocado una sobredosis de insulina, lo que a un paciente le originó un coma diabético.
La carta de advertencia también notificaba que las bombas de insulina estaban violando las normas estadounidenses sobre la calidad de los productos, tales como fugas de insulina, problemas de fabricación, cambios de diseño sin testar, fallos del software o formación inadecuada de los empleados.
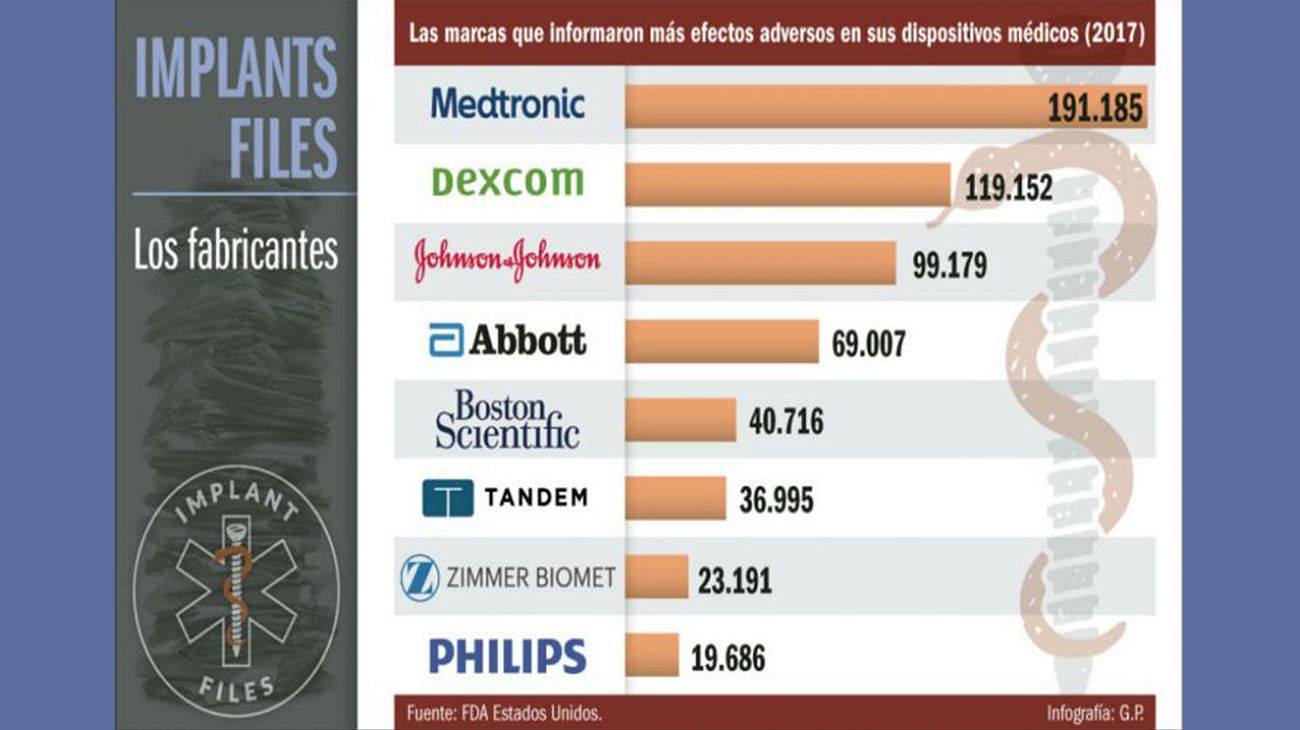
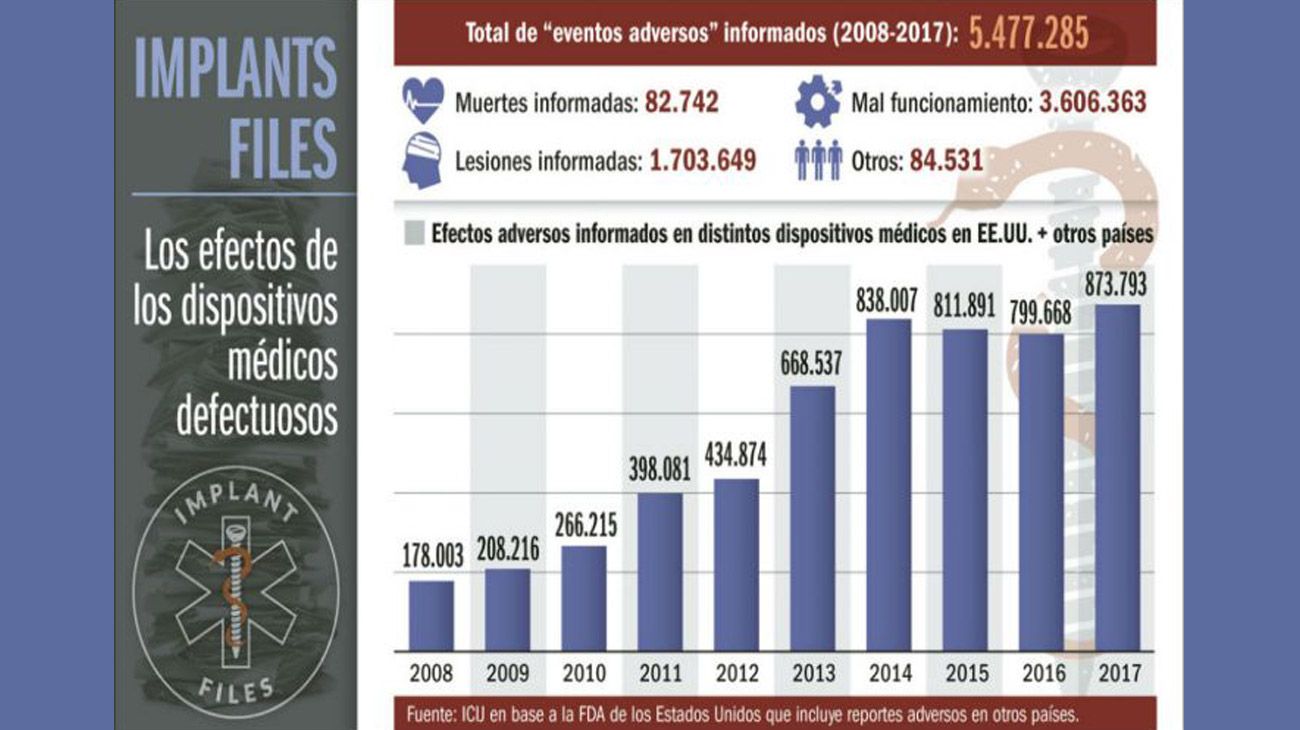
El análisis de ICIJ de la base de datos de la FDA revela que entre 2008 y 2017 las bombas de insulina de Medtronic estarían relacionadas con más de 1.800 muertes y cerca de 96.000 lesiones a pacientes, más que ningún otro tipo de producto sanitario.
Medtronic explicó que esos incidentes adversos comunicados a la FDA sobre fallecimientos y lesiones pueden ser engañosos o estar basados en informaciones incompletas o poco fiables, de modo que es imposible extraer conclusiones sobre si esos aparatos médicos son defectuosos. Su vocero, Rob Clark, asegura que Medtronic siempre comunica a los doctores y a los pacientes en tiempo y forma cuando una retirada del aparato resulta necesaria.
En entrevistas con los medios de la investigación ‘The Implant Files’, familias de Finlandia, Alemania, Canadá, India y Estados Unidos manifestaron que Medtronic actuó lentamente a la hora de responder a sus reclamos y falló en informarles oportunamente sobre los problemas que podían provocar sus bombas de insulina.
En agosto de 2017, en Alahärmä, ciudad occidental de Finlandia, Roope Kauppi, de tan sólo 12 años, se levantó en medio de la noche con niveles peligrosos de azúcar en sangre. Gritó para pedir auxilio. Mientras esperaban una ambulancia, el niño se mareó en los brazos de su padre y perdió la conciencia. Se recuperó, pero sus padres sospecharon que la bomba había inyectado más insulina de la debida. Los padres culpan a Medtronic por no haberles advertido sobre posibles problemas en su funcionamiento.
La familia Kauppi relató que habían enviado la bomba de insulina a Medtronic para que la revisaran. A más de un año del episodio, aún esperan los resultados. “Está bien cuando el aparato funciona, pero puede ser peligroso cuando no lo hace, ya que puede ocurrir cualquier cosa”, explicó el padre del niño.
India: corazones sanos para todos
En 2010, Medtronic se estableció en la India. Uno de los grandes retos que afrontó la empresa fue rebajar el costo de sus productos. La mayoría de los indios no tenían seguro médico y la renta per cápita promedio era de unos 1.500 dólares.
A finales de 2010, Medtronic India lanzó el programa ‘Corazón sano para todos”. Su objetivo era vender marcapasos y stents coronarios a pacientes de bajos recursos y ofrecer préstamos para que los enfermos pudieran pagarlos.
La compañía encontró unos grandes aliados en los hospitales privados de la India. El primero fue el Mission Hospital, una instalación de 360 camas en Durgapur, a unos 160 kilómetros de Calcuta. El hospital pretendía ofrecer cuidados médicos que todo el mundo pudiera costear. Pero su objetivo idealista se topó en seguida con la realidad. “En un principio, nuestro lema era sanidad para todos, pero nada es gratis”, contó el director del hospital, Satyajit Bose, en una entrevista.
Los ejecutivos de Medtronic en la India ofrecieron ayuda al hospital para atraer a nuevos pacientes mediante créditos al consumo y campañas de marketing.
El hospital instaló gratis monitores de análisis de corazón en escuelas y templos rurales. Cientos de pacientes hicieron cola para que les realizaran una diagnosis de sus problemas de corazón. Según el doctor Bose y documentos corporativos de Medtronic, a muchos se les recomendó el implante de un marcapasos, estents coronarios o desfibriladores.
Ya en el hospital, los pacientes podían optar por préstamos que cubrían hasta el 85 por ciento del costo del dispositivo a un interés del 8,25 por ciento, según se lee en documentos comerciales. Los préstamos eran financiados por Medtronic.
A finales de 2012, la campaña había evaluado a 20.000 pacientes y a 2.000 de ellos se les había implantado un dispositivo cardíaco, según Medtronic. Un año después, los hospitales de hasta 20 ciudades tenían un programa similar.
Algunos médicos comenzaron a inquietarse por ese programa, ya que la deuda que estaban asumiendo los pobres era enorme para ellos. También se mostraron preocupados por el hecho de que la financiación de dispositivos médicos pudiera animar a los doctores a recomendar cirugías a pacientes que realmente no las necesitaban.
En 2014, un grupo activista de consumidores de Bombay denunció a la filial de Medtronic en la India y a seis empresas distribuidoras por vender productos a “precios exorbitantes” y pagar sobornos a doctores. Aunque las instituciones no hallaron ninguna evidencia de corrupción, su informe subrayó que los pacientes habían pagado un precio 12 veces superior al valor de importación del producto.
*Han contribuido a la elaboración de este reportaje: Cat Ferguson, Emilia Diaz-Struck, Rigoberto Carvajal, Petra Blum, Christian Baars, Paolo Biondani, Laetitia Cherel, Allan de Abreu, Minna Knus-Galan, Caroline Kubzansky, Jeanne Lenzer, Boyoung Lim, Jesse McLean, Marie Parvex, Kaunain Sheriff, Colm Keena, Giulio Valesini, Christoph Giesen, Holbrook Mohr and Elena Kuch.
Traducción al español: Marcos García Rey.
(Versión adaptada para Perfil.com)