El cáncer es una enfermedad causada por ciertos cambios en los genes que controlan la forma como funcionan nuestras células. Estos cambios (mutaciones) pueden heredarse o adquirirse durante la vida como resultado de errores en el ADN que ocurren al dividirse las células o por exposición a sustancias cancerígenas como el humo del tabaco o los rayos ultravioleta del sol.
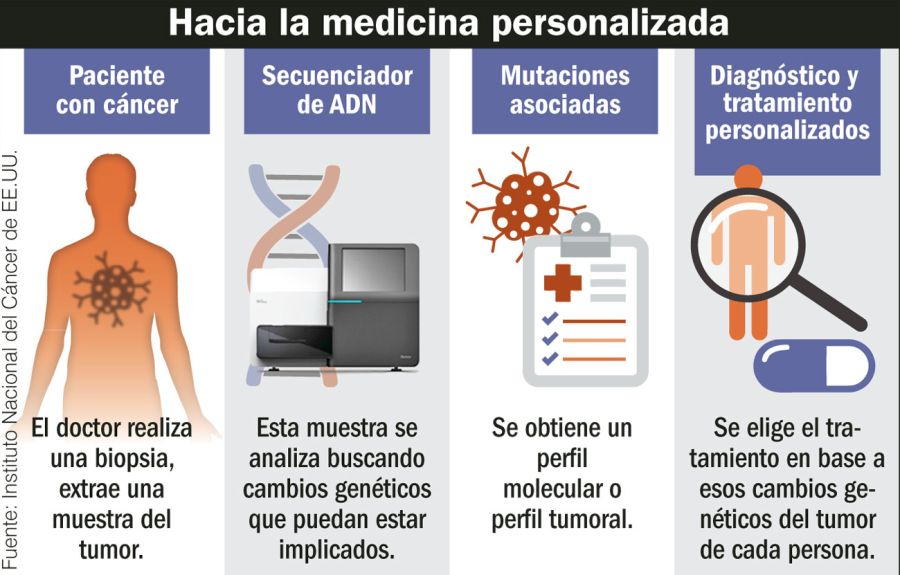
El gran avance de las técnicas de secuenciación del ADN –y sobre todo su abaratamiento– ha permitido identificar y catalogar las mutaciones adquiridas (llamadas somáticas). Actualmente se conocen cerca de 800 genes con mutaciones causalmente implicadas en el desarrollo del cáncer. Pero a pesar de la gran cantidad de datos disponibles, hasta ahora existía poca información sobre la relación entre estas alteraciones genéticas en los diferentes tipos de tumores humanos.
Investigadores de la Fundación Instituto Leloir (FIL) y el Conicet lograron identificar reglas y patrones mutacionales que se dan independientemente de donde está ubicado el tumor, un hallazgo que permite dar un salto de lo cuantitativo a lo cualitativo y tiene implicancias sobre el diagnóstico y el tratamiento del cáncer, uno de los problemas de salud más importantes del mundo. En la Argentina se diagnostican 125 mil nuevos casos de cáncer cada año. En 2016, 62 mil personas murieron a causa de esta enfermedad, según cifras de la Agencia Internacional de Investigación sobre Cáncer.
Los científicos del Laboratorio de Bioinformática Estructural de la FIL realizaron –a través del uso de un software propio– un exhaustivo análisis computacional de 2.800.000 mutaciones genéticas de casi 1.200.000 muestras correspondientes a 47 tipos de cáncer, incluyendo los de mama, páncreas, piel, colon, pulmón y ovarios. Para esto recurrieron a diferentes bases de datos internacionales, como el proyecto The Cancer Genome Atlas y el Catálogo de Mutaciones Somáticas en el Cáncer.
Relación. El estudio, publicado en la revista Human Mutation, identificó pares y redes de mutaciones genéticas que presentan patrones de coexistencia y exclusión mutua en su comportamiento y, a su vez, hay algunos pares que se dan en muchos tipos de tumores y otros que son específicos de un solo tipo de tumor. Por ejemplo, en la proteína llamada P53 se dan dos mutaciones en las posiciones 175 y 282. Mientras que en el cáncer de hígado ocurren juntas (si está una, está la otra), en el de intestino se excluyen mutuamente (si está una, no está la otra).
“Estos patrones entre las alteraciones genéticas no son solo de interés para la investigación básica, sino también para su uso en clínica ya que pueden ser de ayuda en la selección de terapias antitumorales multidirigidas”, le explicó a PERFIL Cristina Marino-Buslje, jefa del laboratorio y una de las autoras del trabajo. “En este sentido, las mutaciones que ocurren juntas sugieren combinaciones de drogas que podrían ser efectivas en el entorno clínico, mientras que las mutaciones que se excluyen mutuamente indican combinaciones que probablemente no sean útiles”, destacó.
Es lo que se conoce como terapia dirigida, un tratamiento contra el cáncer que actúa enfocándose en genes o proteínas específicos para ayudar a impedir que el cáncer se desarrolle y disemine. En el último tiempo se han desarrollado fármacos contra proteínas portadoras de algunas de dichas mutaciones. Por ejemplo, gefitinib y erlotinib contra el gen Factor de Crecimiento Epidérmico mutado en las posiciones 19 y 21. “Actualmente existe un amplio consenso en oncología respecto de la necesidad de desarrollar tratamientos combinados en lugar de monoterapias; es decir, aplicar dos (o más) fármacos en lugar de uno solo, siempre que el perfil de toxicidad lo permita. Nuestro artículo puede ser útil para orientar qué combinaciones de fármacos tienen más posibilidades de ser efectivas en pacientes y cuáles no”, sostuvo Miguel Angel Molina Vila, director del Laboratorio de Oncología del Hospital Universitario Dexeus (España) y otro de los autores del estudio.
Además, no todas las mutaciones son igualmente importantes. Mientras que hay genes cuyas alteraciones confieren a la célula una ventaja selectiva y que, por lo tanto, dirigen el desarrollo del tumor (“mutaciones drivers”), hay otros genes que aparecen mutados que son meros “pasajeros”. “A partir de este estudio vimos que mutaciones consideradas pasajeras tienen un patrón de comportamiento similar a las driver, lo que nos hace repensar cómo están catalogadas”, explicó Elizabeth Martínez Pérez, becaria del Conicet en el grupo de Marino-Buslje y una de las dos primeras autoras del estudio.
Además de apoyar las terapias con valiosa información, el trabajo de científicos del FIL podría motivar una reclasificación de los tumores. “¿Si hay mutaciones que ocurren juntas en algunos tejidos y no en otros, por qué clasificar a los tumores por tejidos? Quizás podríamos clasificar a los pacientes por su patrón mutacional independientemente de dónde ocurre el tumor”, planteó Marino- Buslje.








